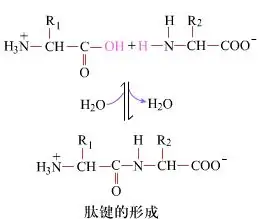
På overflaten er dannelsen av peptidbindinger, som gir dipeptider, en enkel kjemisk prosess.Dette betyr at de to aminosyrekomponentene er forbundet med en peptidbinding, en amidbinding, mens de er dehydrert.
Peptidbindingsdannelse er aktivering av en aminosyre under milde reaksjonsforhold.(A) karboksyldel, andre aminosyre (B) Den nukleofile aktiverte karboksyldelen danner deretter dipeptidet (AB)."Hvis karboksylkomponenten (A) ikke er beskyttet, kan ikke dannelsen av peptidbindingen kontrolleres."Biprodukter som lineære og sykliske peptider kan blandes med målforbindelser AB.Derfor må alle funksjonelle grupper som ikke er involvert i peptidbindingsdannelse beskyttes på en midlertidig reversibel måte under peptidsyntese.
Så, peptidsyntese - dannelsen av hver peptidbinding - involverer tre trinn med aggregering.
Det første trinnet er å forberede noen aminosyrer som trenger beskyttelse, og den zwitterioniske strukturen til aminosyrer eksisterer ikke lenger.
Det andre trinnet er en to-trinns reaksjon for å danne peptidbindinger, hvor karboksylgruppen til den N-beskyttede aminosyren først aktiveres til det aktive mellomproduktet og deretter dannes peptidbindingen.Denne koblede reaksjonen kan skje enten som en ett-trinns reaksjon eller som to sekvensielle reaksjoner.
Det tredje trinnet er selektiv fjerning eller fullstendig fjerning av beskyttelsesbasen.Selv om all fjerning kun kan skje etter at alle peptidkjeder er satt sammen, er det også nødvendig med selektiv fjerning av beskyttende grupper for å fortsette peptidsyntesen.
Fordi 10 aminosyrer (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec og Cys) inneholder sidekjedefunksjonelle grupper, som krever selektiv beskyttelse, noe som gjør peptidsyntesen mer komplisert.Midlertidige og semi-permanente beskyttelsesbaser må skilles på grunn av de ulike kravene til selektivitet.Midlertidige beskyttelsesgrupper brukes i neste trinn for å gjenspeile den midlertidige beskyttelsen av aminosyre- eller karboksylfunksjonelle grupper.Semi-permanente beskyttende grupper fjernes uten å forstyrre allerede dannede peptidbindinger eller aminosyresidekjeder, noen ganger under syntese.
"Ideelt sett bør aktivering av karboksylkomponenten og påfølgende dannelse av peptidbindinger (koblingsreaksjoner) være rask, uten racemisk eller biproduktdannelse, og molare reaktanter bør brukes for å oppnå høye utbytter."Dessverre er det ingen av de kjemiske koblingsmetodene som tilfredsstiller disse kravene, og få egner seg for praktisk syntese.
Under peptidsyntese er de funksjonelle gruppene som er involvert i ulike reaksjoner vanligvis knyttet til det manuelle senteret, glycin er det eneste unntaket, og det er en potensiell risiko for rotasjon.
Det siste trinnet i peptidsyntesesyklusen er fjerning av alle beskyttende grupper.Selektiv fjerning av beskyttende grupper er viktig for peptidkjedeforlengelse i tillegg til kravet om fullstendig fjerning av beskyttelse ved dipeptidsyntese.Syntetiske strategier bør planlegges nøye.Avhengig av det strategiske valget, kan N selektivt fjerne a-amino- eller karboksylbeskyttende grupper.Begrepet "strategi" refererer til sekvensen av kondensasjonsreaksjoner av individuelle aminosyrer.Generelt er det en forskjell mellom gradvis syntese og fragmentkondensering.Peptidsyntese (også kjent som "konvensjonell syntese") foregår i løsning.I de fleste tilfeller kan gradvis forlengelse av peptidkjeden bare syntetiseres ved å bruke peptidkjeden til å syntetisere kortere fragmenter.For å syntetisere lengre peptider, må målmolekylene segmenteres i passende fragmenter og bestemmes at de kan minimere graden av differensiering ved C-terminalen.Etter at de individuelle fragmentene er gradvis satt sammen, vil målforbindelsen bli sammenføyd.Strategien for peptidsyntese inkluderer valg av det beste og mest passende beskyttende fragmentet, og strategien for peptidsyntese inkluderer valg av den mest passende kombinasjonen av beskyttende baser og den beste metoden for fragmentkonjugering.
Innleggstid: 19. juli-2023